Thu hồi toàn bộ thuốc bột pha tiêm do Công ty Samik Pharmaceutical sản xuất
Theo đó, căn cứ vào quyết định số 3861/QĐ-BYT ngày 30/9/2013 của Bộ trưởng Bộ Y tế quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Cục Quản lý Dược thuộc Bộ Y tế. Căn cứ Biên bản làm việc số 93//QLD-BBLV ngày 22/9/2017 của Cục Quản lý Dược.
Xét đề nghị của Trưởng phòng Thanh tra dược, mỹ phẩm, Trưởng phòng Đăng ký thuốc và Trưởng phòng Quản lý chất lượng thuốc- Cục Quản lý Dược quyết định thu hồi giấy đăng ký lưu hành thuốc do Công ty Samik Pharmaceutical Co., Ltd có địa chỉ tại 374-1 Cheongcheon 1-Dong, Boopyeong-Gu, Incheon, Korea) sản xuất ra khỏi Danh mục các thuốc được cấp giấy đăng ký lưu hành tại Việt Nam trong Danh mục ban hành kèm theo Quyết định này.
Cụ thể các loại thuốc bị thu hồi bao gồm:
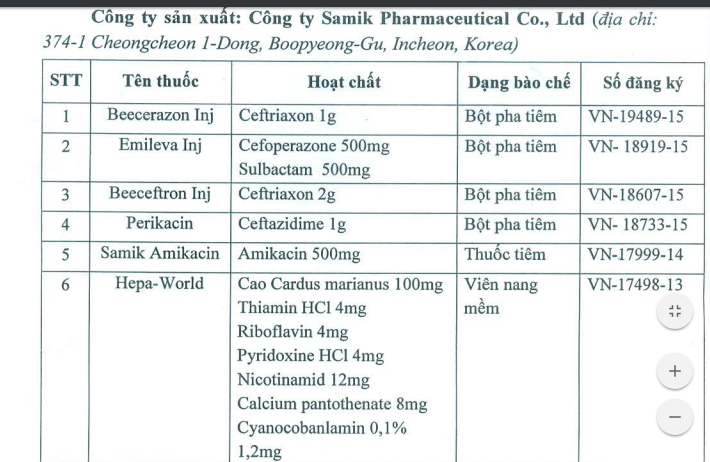
Những sản phẩm thuốc của Công ty Samik Pharmaceutical Co., Ltd sản xuất.
Nguyên nhân dẫn đến việc thuốc bột pha tiêm do Công ty Samik Pharmaceutical sản xuất bị thu hồi là do sản xuất không đúng theo chỉ theo hồ sơ đăng ký. Chính vì vậy, Cục Quản lý Dược quyết định, đình chỉ lưu hành trên toàn quốc và thu hồi toàn bộ các thuốc trong Danh mục ban hành kèm theo Quyết định này.
Bên cạnh đó, Cục Quản lý Dược yêu cầu các công ty đăng ký, nhà sản xuất, cơ sở nhập khẩu, ủy thác nhập khẩu các thuốc nêu trên thực hiện thông báo thu hồi và báo cáo kết quả thu hồi thuốc theo quy định hiện hành.
Ngừng nhận hồ sơ cấp, gia hạn giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc đối với các thuốc do Công ty Công ty Samik Pharmaceutical Co., Ltd sản xuất, đứng tên đăng ký trong thời gian 24 tháng.
Theo đó, các ông (bà), Giám đốc Sở Y tế, các tỉnh, thành phố trực thuộc trung ương, Giám đốc các đơn vị kinh doanh thuốc, Giám đốc cơ sở đăng ký và/hoặc sản xuất các thuốc nêu trên chịu trách nhiệm thi hành quyết định này.

Thu hồi toàn bộ thuốc bột pha tiêm do Công ty Samik Pharmaceutical sản xuất
Trước đó, Cục Quản lý Dược (Bộ Y tế) cũng đã ra quyết định về việc thu hồi số tiếp nhận Phiếu công bố sản phẩm mỹ phẩm và đình chỉ lưu hành, thu hồi mỹ phẩm trên toàn quốc đối với một sản phẩm mỹ phẩm nhập khẩu.
Cụ thể, sản phẩm bị đình chỉ lưu hành, thu hồi là Nu Skin Pure Cleansing Gel do Cosmetic Laboratories of America (CLA) - 20245 Sunburst Street, Chatsworth, CA 91311, Hoa Kỳ sản xuất và Công ty TNHH MTV Nu Skin Enterprise Việt Nam (số 201 Nam Kỳ Khởi Nghĩa, Phường 7, Quận 3, TP HCM) đứng tên công bố, chịu trách nhiệm đưa sản phẩm ra thị trường.
Nguyên nhân được Cục Dược đưa ra là do mỹ phẩm Nu Skin Pure Cleansing Gel có thành phần công thức ghi trên nhãn và công thức sản xuất không đúng như hồ sơ đã công bố. Việc đình chỉ lưu hành và thu hồi bắt đầu từ ngày 2/10/2017.
Đồng thời, Cục Quản lý Dược yêu cầu Công ty TNHH MTV Nu Skin Enterprise Việt Nam gửi thông báo thu hồi tới những nơi phân phối, sử dụng sản phẩm nêu trên. Đồng thời tiến hành tiến hành thu hồi toàn bộ mỹ phẩm không đáp ứng quy định và gửi báo cáo thu hồi về Cục trước ngày 31/10.

Thu hồi sữa rửa mặt Nu Skin Pure Cleansing Gel trên toàn quốc
Cục Quản lý Dược cũng yêu cầu Sở Y tế các tỉnh thành phố trực thuộc Trung ương thông báo cho các cơ sở kinh doanh, sử dụng mỹ phẩm trên địa bàn tiến hành thu hồi các sản phẩm mỹ phẩm nêu trên. Sở Y tế TP.HCM có trách nhiệm kiểm tra, giám sát việc thu hồi của Công ty TNHH MTV Nu Skin Enterprise Việt Nam và báo cáo kết quả về Cục Quản lý Dược.
Bên cạnh đó, Cục Quản lý Dược vừa phát đi thông báo cho các cơ sở y tế trên toàn quốc về tính an toàn của thuốc tiêm Methylprednisolon (giảm đau, hạ sốt, điều trị gút và các bệnh xương khớp) chứa thành phần tá dược Lactose.
Cục Quản lý Dược yêu cầu các cơ sở đăng ký, sản xuất loại thuốc trên cập nhật cảnh báo trên nhãn, hướng dẫn sử dụng: không sử dụng thuốc này trên bệnh nhân dị ứng với protein sữa bò.
Cục cũng yêu cầu các cơ sở y tế tăng cường theo dõi, phát hiện và xử trí các trường hợp phản ứng tác hại của thuốc (nếu có). Gửi báo cáo phản ứng có hại về thuốc về Trung tâm quốc gia về thông tin thuốc và theo dõi phản ứng có hại của thuốc tại Hà Nội và TP.HCM.
- Bắt quả tang cơ sở mổ lợn bị bệnh, lợn chết bán ra thị trường
- Xử lý nghiêm hành vi sản xuất phân bón giả
- Bắt giữ số lượng lớn nước giặt Carefor giả mạo nhãn hiệu
PV






